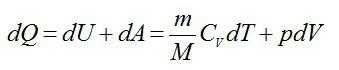Первый закон термодинамики: решение задач
Алгоритм решения задач на первый закон термодинамики ничем не отличается от алгоритма решения любой другой физической задачи. С ним вы можете ознакомиться, открыв нашу универсальную памятку. Также полезно будет держать под рукой формулы, которые часто используются при решении задач.
Задача №1. Применение первого закона термодинамики
Условие
Газ находился в цилиндре с поршнем площадью поперечного сечения 200 см^2. После того, как газ нагрели, сообщив ему количество теплоты в 1,5*10^5 Дж, поршень сдвинулся на расстояние h=30 см. Как изменилась внутренняя энергия газа, если его давление осталось равным 2*10^7 Па.
Решение
Запишем первое начало термодинамики:
Работу против внешних сил, которую совершил газ, можно найти по формуле из механики:
Отсюда:
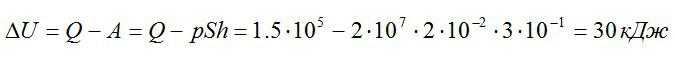
Ответ: 30 кДж.
Задача №2. Применение первого закона термодинамики
Условие
Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое количество теплоты получил или отдал газ в этом процессе?
Решение
Записываем первое начало термодинамики и подставляем значения:
A пишется со знаком «минус», так как это работа внешних сил над газом, а не наоборот.
Ответ: в процессе газ отдал 40 Дж теплоты.
Задача №3. Расчет работы, изменения внутренней энергии и количества теплоты
Условие
Кислород нагрели при постоянном давлении p=80 кПа. Объем газа увеличился с 1 до 3 кубических метров. Определить изменение внутренней энергии кислорода, работу, совершенную газом, и количество теплоты, сообщенное ему.
Решение
Работа газа
Изменение внутренней энергии равно:
Используем уравнение состояния газа:
Число степеней свободы i для двухатомной молекулы равно 5.
Согласно первому закону термодинамики, сообщенное газу тепло равно:
Найдем:
Ответ: А=160 кДж, ∆U=400 кДж, Q=560 кДж.
Задача №4. Изопроцессы
Условие
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Решение
Так как нагревание газа происходит при постоянном объеме, процесс – изохорный. При изохорном процессе:
Ответ: 600 К.
Задача №5. Расчет изменения энтропии
Условие
Найти изменение ∆S энтропии при расширении массы m = 6 г гелия от объема V1 = 20 л под давлением р1 = 150 кПа к объему V2 = 60 л под давлением р2 = 100 кПа.
Решение
Изменение энтропии при переходе вещества из состояния 1 в состояние 2:
Согласно первому началу термодинамики:
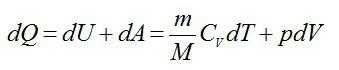
Из уравнения Менделеева-Клапейрона выразим давление:
Тогда:
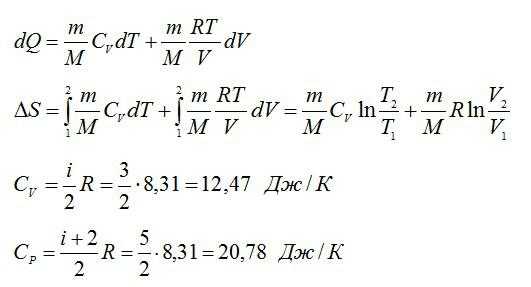
Из уравнения Менделеева-Клапейрона:
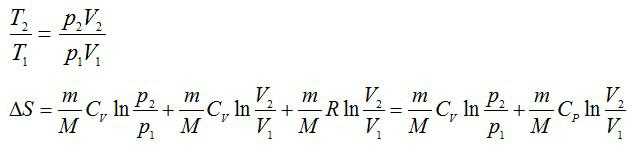
Подставим числа:
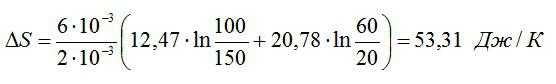
Ответ: ∆S=53,31 Дж/К.
Кстати! Для наших читателей действует скидка 10% на любой вид работы.